NEWS

公司新聞
青松醫藥喜獲米拉貝隆進口原料藥批準,登記號Y20200001331

2023年5月25日,由青松醫藥獨家經營、青松醫藥全資子公司泊諾醫藥獨家申報注冊的ZCL米拉貝隆原料藥在CDE成功獲得A狀態,登記號Y20200001331:

01
品種信息
米拉貝隆(Mirabegron)為選擇性β3腎上腺素受體激動劑,通過作用于膀胱組織,使膀胱平滑肌松弛,從而增加了膀胱容量,用于治療膀胱過度活動癥(OAB)的癥狀,如急迫性尿失禁、尿急和尿頻。
米拉貝隆由日本安斯泰來(Astellas)制藥公司開發,于2011年9月16日在日本上市,2012年6月28日經美國食品藥品監督管理局(FDA)批準用于治療成年人膀胱過度活動癥,是第一個用于治療膀胱過度活動癥的β3腎上腺素受體激動劑類藥物,填補了β腎上腺素受體激動劑在治療膀胱過度活動癥方面的空白,為膀胱過度活動癥患者提供了新的治療方案, 其片劑服用方便、 服用劑量小、 藥效顯著, 能明顯減輕膀胱過度活動癥患者的痛苦。根據歐洲和北美的研究,米拉貝隆不會造成心血管副作用。
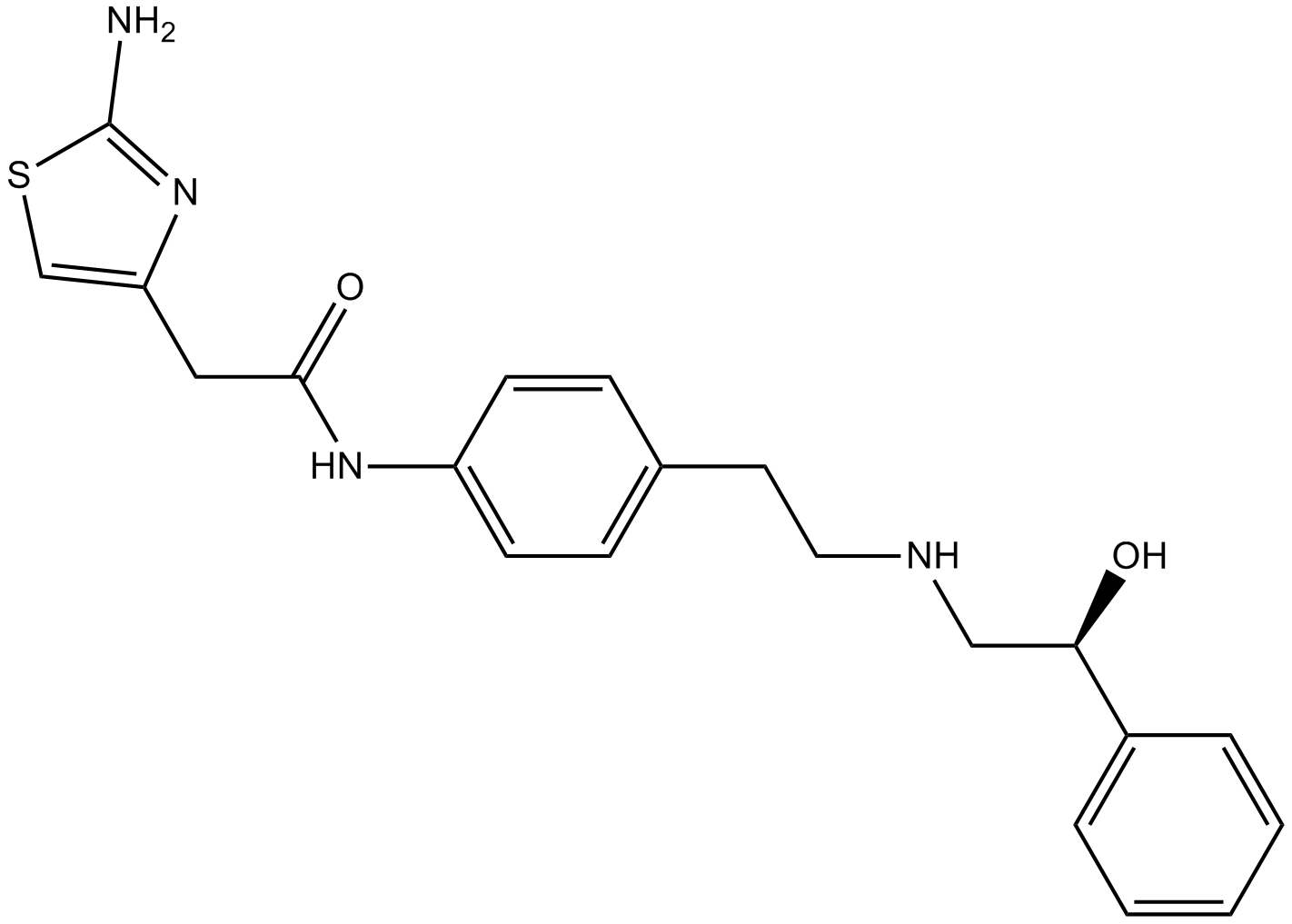
米拉貝隆分子結構示意圖↑
02
原研上市信息
商品名:貝坦利®/ Betanis®
劑型&規格:
緩釋片:25mg, 50mg,
03
供應商信息
ZCL 成立于1991年,總部位于印度孟買,是印度業界領先的出口型藥企。ZCL有4座cGMP工廠,工廠經過了USFDA、EDQM、KFDA、WHO GMP等多個官方機構的審計。
04
原料資訊
1. 獲批登記號:Y20200001331
青松醫藥擁有專業的注冊、銷售團隊,在原輔料的引進和推廣上已有超過20年的經驗。我們將持之以恒,為國內廣大醫藥企業不斷帶來品質優良、價格適配度高、供應及時有保障的醫藥產品。歡迎國內廣大客戶前來溝通垂詢!
歡迎關注我們的產品目錄:進入“青松原輔料”公眾號聊天界面,點擊“產品目錄”即可獲取不同分類的產品名單!
05
聯系我們


本文章可能包含一些醫療條件、醫療方法和產品信息。這類信息只作為信息提供,并不含有關于使用任何制劑藥物、外科設備、治療或口服產品的廣告或意圖,不能取代向醫生或其他有資格的醫療專業人士進行咨詢。您不能將這里包含的信息用于醫療、保健中問題的解決或疾病的診斷。如有需要,請您自始至終向醫生或其他有資格的醫療專業人士進行咨詢